在情境教學中落實立德樹人
——以電化學教學課例片段為例
作者:■文/王海燕
發布時間:2024-03-05 09:33:22 來源:陜西教育·教學
以電化學教學內容為依托,以新課標為藍本,在以“素養為本”的教學理念下,通過形式多樣的情境教學,產生一個個任務驅動誘發思維,讓知識體系在解決任務的過程中構建。本文從五種情境的設定展開,闡述了通過情境教學發展學生核心素養,落實立德樹人教育目標的具體做法。
一、問題提出
2018年1月,教育部頒布了《普通高中化學課程標準(2017年版)》(以下簡稱新課標),明確了普通高中教育的目標定位。學生從課本上獲取知識的最終目的是要轉化為能力并服務于社會。這就需要提升學生的綜合素質,學校的主戰場是課堂,在課堂教學中將知識內化為能力,形成化學學科觀念,以發展學生學科核心素養。在以“素養為本”的教學理念下,學習不再是簡單的傳授,而是引導學生自主建構知識體系,這種建構過程需要一定的情境作為載體,在情境中承載著一個個任務和問題。在任務問題的驅動下,學生培養了能力,發展了素養。問題情境設定越真實,越能承載問題。教師為學生搭建重要平臺,學生才能在這個平臺上將已有知識與創設的情境通過思維的紐帶在合作、討論中形成化學學科核心素養。
電化學教學內容分布在必修和選修兩本教材中,必修部分只討論原電池和簡單的化學電源,在選修部分增加了電解池及金屬的腐蝕與防護,教材這樣編寫體現出對知識掌握的螺旋式上升過程,所以教學環節的設計要本著不隨意拔高、從學生的實際認知水平出發,如此才能設計出符合學生思維認知水平的教學情境。學習建構主義理論使我認識到學生對知識的建構在其學習的過程中就已經產生了。電化學中有豐富的情境素材,如電動自行車用的鉛酸電池和手機用的鋰離子電池,還有各種科研資料所呈現出的新型電池,都讓學生體驗到科技的進步。同時,電化學也是每年高考的高頻考點,通過創設情境設計多層次、多視角的問題鏈,引導學生用已學知識去解決問題,在解決問題的過程中建構知識體系,這有利于學生核心素養的落實與培養。新課標里提出從五個方面發展學生化學學科素養,這五個方面是宏觀辨識與微觀探析、變化觀念與平衡思想、證據推理與模型認知、科學探究與創新意識、科學態度與社會責任。
二、課例的設計與實施
1.科學史話情境設計——電池的發現與發明
問題情境:生活中司空見慣的電池是怎么被發現與發明的?有什么有趣的故事?
教師引導學生從網絡上尋找電池的發展史:查詢的過程中,體驗著一個個歷史人物在電池發現過程中的精彩瞬間。意大利解剖學家伽伐尼醫師在1780年解剖青蛙時發現,由于金屬器械碰到肌肉而使青蛙腿部的肌肉抽搐,從此開啟了電池的發明之旅,特別要提的是意大利科學家亞歷山德羅·伏特,他對前人的實驗現象感興趣,卻不茍同其觀點,于是玩起了游戲:他用導線連接一個金幣和一個銀幣通上電源,然后把這兩個硬幣同時放在自己的舌頭上,瞬間舌頭發麻。這是何等的科學獻身精神啊!他就是從“玩”中不斷總結規律,寫出了有價值的論文,在1800年3月20日把自己的研究成果呈現給世人。隨后的60年中,經過不斷改進發明了碳鋅電池,這是干電池的鼻祖,又過了17年,最早的干電池被發明出來,并獲得廣泛應用。這段歷史讓學生明白:電池的發現與發明有一百多年,經歷了至少四位有貢獻的科學工作者的努力。若沒有觀察力與細心,又怎能有最初的“生物電”?若沒有興趣使然的“玩”,又何來“伏達電池”?以及現在形形色色的蓄電池、燃料電池?通過化學史的教學,讓學生明白任何不經意的現象都有可能是一個重大發現,任何一個成熟的技術都是前人不懈努力的結果, 這難道不是“證據推理與模型認知、科學探究與創新意識”這些核心素養實施的好材料嗎?其實在我們的課堂上,潤物細無聲地設計類似這樣的教學情境,從內心喚起學生發明創造的欲望,使他們明白“任何發明都是從實踐中來到實踐中去”的哲學辯證觀點,不僅能很好地提升學生的思維品質,還可以培養他們對科學的探索奉獻精神。
2.趣味實驗情境——水果電池的探究
問題情境:哪些水果能組成原電池?電流大小如何?影響因素有哪些?如何改進?
學生從原電池的形成條件并且聯系物理知識知道電子是從低電勢流向高電勢的,兩電極電勢差越大,電流強度越大,電解質溶液的濃度大小也對電流產生影響。為了增強學生對電化學的學習興趣,教師特意安排了一節水果電池的探究課。學生帶上不同的水果,教師準備必要的金屬導體、導線、電流表等。開始時,學生是隨意地連接組裝電池,當發現電流表指針偏轉程度不同時就產生了疑惑,于是幾個學生主動探討起來,他們發現不同水果組成的電池指針偏轉不同,其中檸檬水果電池偏轉最大;但同一種水果電池,兩個電極分別是鎂—銅、鐵—銅,其電流表指針偏轉前者大;都用檸檬水果味電池,都用鐵—銅做電極時發現插入水果的深度也影響電流的大小;把兩個電極的距離變大,發現電流變弱。學生在探究、發現、討論中感悟著“真實驗”帶來的愉快。從水果的種類、水果的酸甜度(成熟度)、電極材料、電極間的距離、電極插入水果的深度等角度大膽進行探究,總結出這些都是影響水果電池產生電流大小的因素。看似一節與高考考試無關的課,但其影響深遠。本節課的實驗特點是先讓學生“玩”,在“玩”中找到問題、誘發思維、產生質疑、共同討論、提出探究的問題和假設,并根據假設設計試驗方案、探索實驗中的意外現象,然后基于現象進行問題分析,最后得出相應結論。這雖然是一個簡單的興趣探究實驗,但也讓學生在“玩”中體驗到設計實驗并完成實驗遠比得出結論更重要,同時也體驗到控制變量是實驗設計的重要思維要素。這其中“證據推理與模型認知、科學探究與創新意識”等核心素養得以凝練,使學生思維的嚴謹性得以發展,也培養了他們合作探究的團隊精神。
3.遞進問題情境——概念規律的動態認知
問題情境:電解池中只有離子才能在電極上放電嗎?電解時陽(陰)離子能在陽(陰)極放電嗎?兩極反應一定按離子放電順序進行嗎?存在所謂的“亂放電”現象嗎?
學生對于電化學中原電池和電解池的工作原理比較容易掌握,知道離子在電極上放電都遵循一定的規律,但有沒有所謂的“亂放電”現象呢?比如,分子放電?陽離子在陽極放電?陰離子在陰極放電?含氧酸根參與放電呢?當問題提出后,學生不知所措,于是從高考真題中選取有“教”的價值的題作為問題情境,我們通過設疑,誘發學生思維。
在2018江蘇卷中有一題,要求學生利用電解原理用惰性電極電解HNO3和HNO2的混合溶液,從而獲得較濃的硝酸。按照電解規律陽極放電離子是OH-,產生氧氣,但與題意所述獲得濃的硝酸相去甚遠,這就使學生產生了思維疑點,該如何破解?教師引導學生結合元素化合物的知識:OH-放電產生的氧氣將具有還原性的HNO2氧化,就會生成HNO3,這樣兩個反應疊加后的結果就是HNO2-2e-+ H2O=3H++NO3-。HNO2是分子,也在電極上能放電,可見分子也可在電極上參與電極反應,其核心問題是要有得失電子的微粒。
2013年重慶高考題中用電化學法降解含NO3-的廢水,以獲得硝酸的實例,也是在陰極發生電極反應2NO3-+12H++10e-= N2↑+6H2O,可以看出此時是陰離子在陰極放電的事實。無獨有偶,2014北京卷中,在設計實驗完成電解酸性的FeCl2的廢液使FeCl3再生的實驗時用到電解手段,其陽極電極反應式為Fe2+-e-=Fe3+,離子的還原性還與電壓有關,也可能是2Cl--2e-=Cl2,Cl2又將Fe2+氧化成Fe3+,從而使FeCl3再生。這其中就體現了兩極反應不一定按離子放電順序進行,而是要受濃度、溫度、酸堿性、電壓等因素的影響。
我們通過以上三個習題練習,先提出問題, 設置思維疑點會導致學生思維與認知的沖突,使其對所學知識產生懷疑,這時引導學生首先明確電極放電的實質是發生氧化或還原的微粒,與是否為陰陽離子無關。可以是分子,從而辯證的認知電極反應,引發學生認識電化學中“氧化還原理論”的核心指導地位。其次,使學生明確任何規律都有一定的使用范圍,要建立從動態變化的思維視角看待離子的放電順序,建立濃度、溫度、酸堿性、電壓等對微粒氧化性、還原性的影響的思維認知模型。學會將對立統一思想和定性定量相結合,揭示化學變化的本質特征,凝練“變化觀念與平衡思想”這一核心素養。
進一步創設問題情境:構成原電池的條件中一定要有一個自發的氧化還原反應嗎?再次引發思維“大地震”,難道不是嗎?若不發生氧化還原反應,哪有電子的得失?沒有電子的定向移動怎么形成電流?這一系列的問題,首先要拿事實說話,教師展示一段報道:“挪威和荷蘭正在開發一種能源,這種能源是由于海水和淡水的濃度不同,海水對于淡水存在滲透壓以及稀釋熱、吸收熱、濃淡電位差等濃度差能,這種濃度差能可以使溫度升高將近0.1℃,這種能源是一種可再生的海洋能源。如果把世界上所有的海港結合起來,這一能源將相當于電力需求的20%。”這段報道從能量轉換的角度出發,拓寬了學生的思維,指導他們分析和考慮鹽差能和電能的轉換,它類似于化學能轉化為電能,故而就不難理解電池沒有自發的氧化還原反應,沒有了“動力”基礎,也會由于濃度差能形成“濃差電池”,這就對原電池的形成條件有了更深刻的認識。這樣的問題創設無疑能拓寬學生思維,對培養高素質人才具有“助推劑”的作用。
4.創設習題情境——試題的發展與思辨
問題情境:兩道對比題。
例題1:電解法處理酸性含鉻廢水(主要含有Cr2O72-)時,以鐵板作陰、陽極處理過程中存在反應 Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去,問電路中每轉移6mol電子,最多有 mol Cr2O72-被還原。(答案: 0.5)
例題2:實驗室模擬電解法處理含六價鉻的工業廢水,如圖裝置將主要有害物Cr2O72-轉化為Cr3+(無害)除去。得到如下實驗結果:
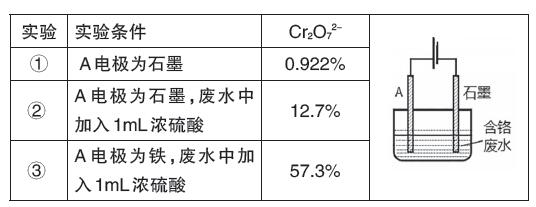
實驗中,理論上電路中每通過6mol電子,則有 mol Cr2O72-被還原。(答案:1.5)
同一個問題,為什么兩個題的結論不同,按照電化學中最核心的問題分析Cr2O72-在陰極放電完全可以,與上述2013年重慶高考題中NO3-在陰極放電類似(Cr2O72-在陰極放電的電極反應式為:Cr2O72-+6e-+14H+=2Cr3++7H2O)。而2013年高考大綱卷為什么沒有考慮呢?這除了與題干信息有關外,教師要引導學生辯證看待高考真題,其實它也在不斷的發展中,有些問題可能是當時有意回避和降低難度所為。教師引導學生要辯證看待高考試題,這也凝練了要用發展的思維視角看問題,如此才能培養出有健全思維的人。
5.新科技新發現情境——技術的應用與改進
問題情境:有關膜技術廣泛應用,在生產實際中,如圖1所示(用電化學手段制備FeCl3,從而使FeCl3再生的示意圖),請問有需要改進嗎?
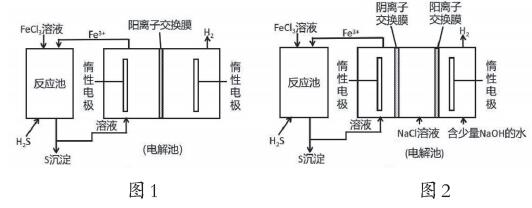
教師引導學生分析得出,陽離子交換膜左側為陽極區,Fe2+-e-=Fe3+,右側為陰極區,2H++e-=H2,讓學生分析此時是陽離子交換膜,根據離子移動規律,左側的Fe3+、Fe2+會移向右側,會與右側的OH-結合形成沉淀。這樣會影響Fe3+的再生,故而該裝置在設計上有待改進。我們引導學生從膜的作用入手,在陽離子交換膜的右側陽極區增加一個陰膜(圖2),在兩膜之間加入NaCl溶液,右側陰極區加入含少量NaOH的水,這樣就不會影響到FeCl3的再生純度,又在陰極區不影響H+放電,額外地又獲得了NaOH,這種改進理念正是“科學態度與社會責任”素養的體現,學生運用所學知識,針對化工工藝中存在的設計缺憾,提出解決方案和改進措施,將節約成本、循環利用、環境保護等觀念滲透在改進工藝的過程中,這些對于學生最終形成學科核心素養、發展關鍵能力是十分必要的。
三、反思教學
高中化學教學模塊中電化學是重要的一部分內容,涉及在必修和選修兩個課程結構中,不論是初學者還是高三復習學生總感到這部分內容記不住、有些亂、方程式多。但這部分內容又是高考的必考內容,所以通過課程內容情境化,能激發學生學習的內驅力,通過設計一個個問題鏈,感受電化學中的一些反常現象,使學生明確任何規律都有一定的使用范圍,建立從動態變化的思維視角看待離子的放電順序,這也就解決了記不住、有些亂的問題了。電化學的高考真題能很好地體現最新型的化學電源,也為教學提供了很好的習題情境,所以依托高考真題,展開對電化學的學習和深化,明確電化學的最核心的問題是在氧化還原理論指導下,充分理解和認識原電池和電解池中離子的移動規律、放電原理,從而解決工業生產、生活中的實際問題,以此促進學生自主分析、主動參與的意識。
教師在教學中應善于從眾多的、豐富的信息中挖掘有價值的線索創設問題情境,誘發學生思維,在真實的情境下形成有效能的任務驅動,通過對信息進行加工和處理形成自己的認識,以最有效的對話即自我對話讓知識內化于心,促進學生化學學科素養的形成和發展,落實立德樹人的教育目標。
作者單位 西安市鐵一中學


 投稿
投稿 APP下載
APP下載





























