借助數字化實驗 創新化學教學模式
——以“水的電離和溶液的pH”教學設計為例
作者:■文/張運飛 張忠孝 閆 君
發布時間:2023-10-08 16:09:12 來源:陜西教育·教學
數字化實驗因其具有可視化、數據采集及智能化等優點,被廣泛應用于化學實驗教學中。本文是數字化手持技術在化學概念教學中的有效嘗試,筆者采用數字化實驗測定純水電導率,證明了水是極弱的電解質。
一、教材分析
《普通高中化學課程標準(2017年版2020年修訂)》在“水溶液中的離子反應與平衡”中指出:“認識水的電離,了解水的離子積常數,認識溶液的酸堿性及pH,掌握檢測溶液pH的方法。”水的電離及電離平衡移動知識對學生了解溶液的酸堿性、pH具有重要的意義,為學生學習鹽類的水解,以及第四章電化學知識奠定了基礎。
人教版化學選擇性必修一第三章“水溶液中的離子反應與平衡”第2節“水的電離和溶液的pH”第1課時分為三個部分:水的電離、溶液的酸堿性與pH、酸堿中和滴定。教材以水的電離為突破口,直接以一句“精確的導電性實驗表明,純水絕大部分以H2O的形式存在,但其中也存在極少量的H3O+和OH–”,說明水是一種極弱的電解質,能發生微弱的電離。概念的生成平鋪直敘,學生核心素養無法得到有效培養和發展。
二、學情分析
1.已知點。學習本課前,學生通過學習必修二、本冊第二章、本章第一節“電離平衡”已經知道了化學平衡狀態的意義及特征,掌握了弱電解質的電離平衡、化學平衡常數、影響平衡移動因素等知識。
2.障礙點。由于水的電離平衡比較抽象,學生理解水的電離平衡及水的離子積常數適應范圍有一定的難度。
3.發展點。在教學過程中,筆者以弱電解質的電離為基礎,以水的電離為突破口,基于實驗事實,為學生介紹水的電離、水的離子積常數適應范圍、溶液的酸堿性與pH的關系等,并幫助學生樹立微粒觀、變化觀、平衡觀等。
三、教學目標
1.讓學生使用數字傳感器測水的電導率,了解水是一種極弱的電解質,可以發生微弱的電離。
2.讓學生使用數字傳感器測水在不同溫度下的pH,了解弱電解質的電離平衡狀態及平衡常數,認識水的電離平衡,掌握水的離子積常數的適應范圍。
3.讓學生利用水的離子積常數計算酸堿溶液中c(H+)和c(OH–)的值,構建溶液的酸堿性與c(H+)和c(OH–)的關系模型。
四、重難點
1.重點。本課重點知識包括兩個方面:一是水的電離及水的離子積常數,二是溶液的酸堿性與pH。
2.難點。本課的難點是水的電離平衡的證明,以及水的離子積常數的應用。
五、教法學法
1.教法。在日常教學過程中,筆者一般會采用情境創設、實驗創新、師評解惑的教法。
2.學法。在學習過程中,學生一般會采取實驗探究、合作交流、閱讀歸納的學法。
六、課堂教學創新點
在本課教學中,筆者以分析冰醋酸稀釋過程的數字化實驗曲線圖為教學起點,為學生創設真實而有價值的問題情境,讓學生直觀地感受實驗的操作過程,形成學科核心素養(詳見圖1)。
七、教學過程
提出問題:在一定溫度下,冰醋酸未加水前導電能力幾乎為零的原因是什么?最終幾乎不變的原因可能是什么?
學生分析:未加水前醋酸以分子形式存在,不存在自由移動的離子,導電能力為零。最后趨于定值,是水可能發生電離,使溶液中的離子濃度幾乎不變,電導率幾乎不變。
設計意圖:通過前一節《電離平衡》的學習,學生已經掌握了弱電解質的電離及電離平衡相關知識,知道醋酸是弱電解質,了解了其在加水稀釋過程中溶液導電能力的變化趨勢。筆者根據學生已有認知,以前一課課后習題為素材創設情境,用真實而有效的問題情境引發學生猜想,激發學生探究欲望。
任務1:設計實驗證明水能電離
學生實驗:室溫下,使用數字傳感器測量純水的電導率(詳見圖2)。

教師總結:水是一種極弱的電解質,能發出微弱的電離。
設計意圖:通過醋酸稀釋實驗,學生很自然就會想到可以測定純水電導率驗證水是否能發生電離,并使用數字化傳感器測定純水的電導率,驗證猜想,感受水的微弱電離。在此過程中,學生的實驗探究能力、創新意識、證據推理與模型認知等核心素養能夠得到很大的提升。
提出問題:水可以電離出哪些離子?寫出水的電離方程式。
學生回答:H2O + H2O[]H3O+ +OH–;簡寫:H2O[]H+ +OH– 。
提出問題:為何使用可逆符號?
學生回答:水分子電離成氫離子和氫氧根離子,而氫離子和氫氧根離子又重新結合成水分子,過程可逆,說明水是弱電解質,存在電離平衡。
提出問題:純水的電導率測定實驗能否說明水是弱電解質呢?
學生回答:純水的電導率數值很小,水的導電性很弱,水電離出的離子很少,說明水為弱電解質。
設計意圖:水的電離微觀不可視,學生無法感知其電離過程。筆者借助視頻讓學生直觀感受水的電離過程,總結水的電離方程式,以此培養學生觀察、分析及表達能力。
任務2:還有哪些方法可以證明水是弱電解質呢?
提出問題:電離程度究竟如何呢?
信息1:25℃時,測得1L的H2O(約55.6 mol)中c(H+)和c(OH–)都是1.0×10-7mol·L-1 。
信息2:H2O[]H+ + OH–,△H>O。
學生回答:可以測不同溫度下純水的pH,證明水是弱電解質,因為水的電離是吸熱過程,溫度升高,水的電離程度增大,氫離子濃度增大,pH減小。
演示實驗:使用數字傳感器探究溫度對水pH的影響(詳見圖3)。
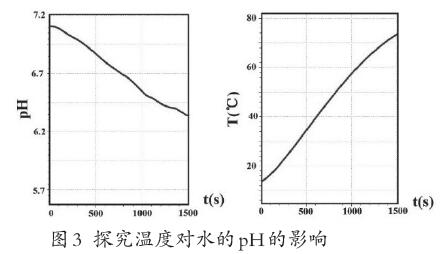
提出問題:實驗結果和大家預測的一樣嗎?什么現象說明水中存在電離平衡呢?
學生回答:剛開始溫度不變,水的pH不變,說明水中的氫離子濃度不變。加熱后pH隨著溫度升高而減小,說明隨著溫度的升高水中的氫離子濃度逐漸增大,水的電離正向進行,證明水中存在電離平衡。
設計意圖:根據學生已知信息,從變化觀和能量觀角度讓學生通過數字化實驗探究水中存在電離平衡,以此培養學生的實驗設計能力,發展學生的“變化觀念與平衡思想、證據推理與模型認知”等核心素養。
任務3:了解水的離子積及適應范圍。
學生根據弱電解質的電離平衡相關知識,寫出了水的離子積常數:
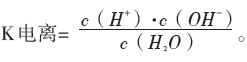
教師分析:室溫下與未電離的H2O相比,發生電離的H2O可以忽略不計,c(H2O)不變,可以視為常數,K電離·c(H2O)也是常數,稱作水的離子積常數,記作Kw=c(H+)·[c](OH–)。
數據分析:不同溫度下水的電離差異(詳見表1)。
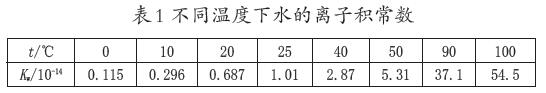
教師總結:與其他平衡常數一樣,水的離子積常數也是溫度常數,溫度升高,水的離子積增大,水的離子積常數不僅適用于純水,也適用于稀的電解質溶液。
設計意圖:讓學生根據已有電離平衡知識,寫出水的電離積常數表達式,掌握水的離子積常數概念,知道水的離子積常數不僅適用于純水,還適用于稀的電解質溶液。
任務4:構建溶液的酸堿性與c(H+)和c(OH–)的關系模型。
數據處理:室溫下,請根據相關數據填寫表2空缺的數據。
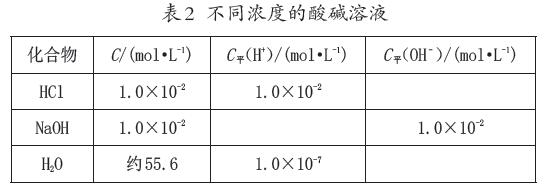
學生活動:依據水的離子積常數,計算出酸堿溶液中c(H+)和c(OH–)的值。
提出問題:從表中數據你們發現了什么?
教師分析:不管酸性溶液還是堿性溶液,都存在氫離子和氫氧根離子:酸溶液中Kw=c(H+)酸·c(OH–)水(忽略水電離出的H+);堿溶液中Kw=c(H+)水c(OH–)堿(忽略水電離出的OH–)。在其他條件不變時,向水中加入酸或堿,水的電離受到抑制。
設計意圖:讓學生根據水的離子積常數計算酸堿溶液中c(H+)和c(OH–)的值,觀察數據,分析數據,構建溶液的酸堿性與c(H+)和c(OH–)的關系模型,培養學生分析歸納、模型構建的能力。
這是一節基于數字化實驗開展的深度教學,無論是教法上的情境創設、實驗創新、師評解惑,還是學法上的實驗探究、合作交流、分析歸納,都是為了培養和發展學生的核心素養,讓學生真正理解水的電離平衡及水的離子積常數的含義。在本課教學過程中,筆者多次使用數字化實驗,充分激發了學生的學習興趣,有效培養了學生的創新精神和實踐能力,培育了學生的學科核心素養。
作者單位 西安市第七十中學 西安市創新港中學

 熱點新聞
熱點新聞
 深度報道
深度報道
 新聞視頻
新聞視頻

 投稿
投稿 APP下載
APP下載


























